Eso es correcto, hay una serie de metales no deseados, o de metal (Cu, Sn, Sb, As) que ingresan a la corriente de reciclaje de, por ejemplo, carrocerías de automóviles que se trituran sin eliminar todo el cableado de cobre o estaño. -latas de acero recubiertas. El antimonio y el arsénico tienden a infiltrarse de fuentes primarias de hierro de baja calidad y bajo costo.
La respuesta a la pregunta es no. El acero reciclado se mezcla lo más uniformemente posible de diversas fuentes, se mide su composición y luego se agrega hierro puro según sea necesario para diluir los metales atrapados a niveles tolerables para reventa o procesamiento adicional, como cumplir con un grado de acero específico para un producto específico o aplicación. Los aceros inoxidables y otras calidades de alta aleación que se conocen en el momento del reciclaje se procesan por separado debido al valor de Ni, Cr, etc.
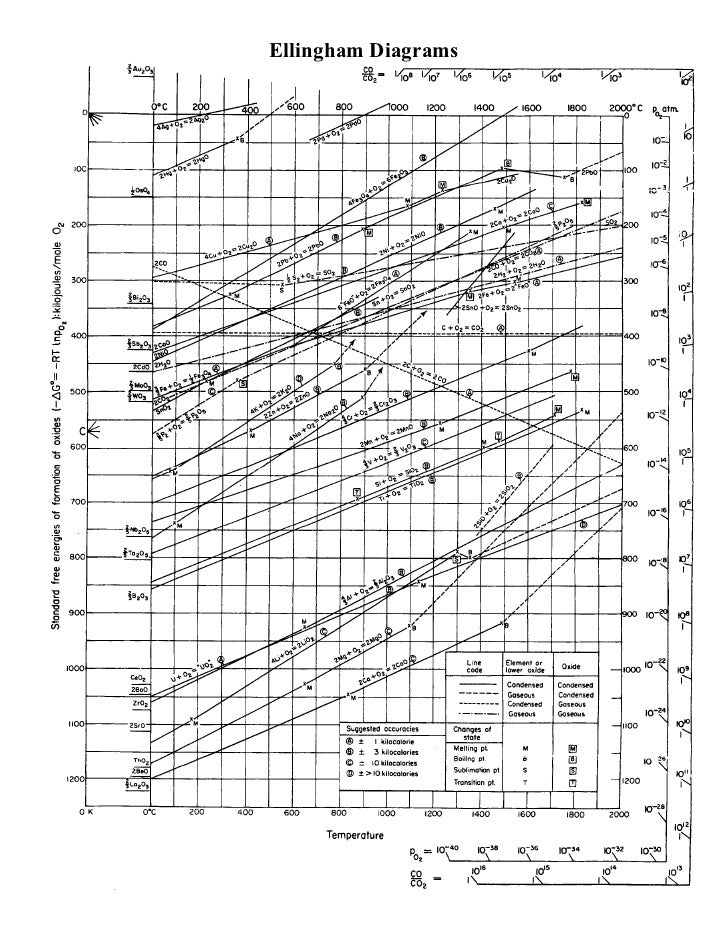
Actualmente no es económico volver a procesar el hierro para eliminar elementos de vagabundo, por lo que simplemente no se hace nada. Dos libros mencionan el proceso como uno regular y económico: ( Minerales, Metales y Sostenibilidad: Satisfacer las necesidades futuras de materiales , p. 284, comenzando en "dilución") y ( Producción de acero: procesos, productos y residuos, comenzando en la p. 104, leer hasta que ya no sea relevante). La razón por la que no es económico es que los elementos de la trampa reaccionan más débilmente con el oxígeno que el hierro a temperatura constante, por lo que eliminarlos por oxidación requeriría oxidar primero todo el hierro. La razón de esto es termodinámica, y se basa en el hecho de que entre las reacciones competidoras, aquellos con las mayores disminuciones en la energía libre proceden prácticamente a completarse antes de que otras reacciones comiencen, especialmente con grandes diferencias en la energía libre entre las reacciones en competencia. Para determinar qué reacciones tienen las mayores disminuciones, se puede usar un diagrama de Ellingham.
En el siguiente diagrama de Ellingham, el eje horizontal es la temperatura, el eje vertical es el cambio en la energía libre de Gibbs. Las líneas que atraviesan el diagrama en varios ángulos corresponden al cambio de energía libre causado por las reacciones de oxidación del elemento con oxígeno, en función de la temperatura. En nuestro caso, el diagrama puede leerse eligiendo una temperatura de interés y leyendo desde abajo para encontrar el primer elemento que reaccione con el oxígeno. Por ejemplo, si tenemos acero con Fe, Mn, Sn y Cu, podemos ver que a 1000K, entonces Mn, Fe (a FeO), Sn y Cu son el orden de mayor a menor caída de energía libre.
Por supuesto, la temperatura de interés está más cerca de 1900K (por encima del punto de fusión del hierro), pero las tendencias generales de cada función de cambio de energía libre de Gibbs continúan a la derecha en el diagrama y el hierro permanece debajo de los elementos de vaciado Cu, Sn, As y Sb a temperaturas prácticas, y probablemente a sus respectivos puntos de ebullición. Como resultado, eliminar vagabundos de Fe requeriría oxidar efectivamente todo el hierro primero. Y debido a que Sn, Sb, As y Cu son ligeramente solubles en hierro, requieren separación por reacción química.
Uno puede ver la solubilidad de los vagabundos a partir de sus diagramas de fase con hierro, de los cuales he publicado Sb-Fe a continuación. El diagrama tiene temperatura contra composición, con cada región 2D contigua compuesta de una fase o una mezcla de las dos fases a su izquierda y derecha, que están en equilibrio en esa combinación de temperatura y composición. En la parte inferior izquierda vemos que para pequeñas cantidades de Sb y temperatura ambiente, hay una región contigua que en este caso denota una sola fase, o alfa-Fe (el tipo con el que estamos familiarizados). Debido a que hay Sb presente, y está en una sola fase, debe disolverse en el hierro. Lo mismo es cierto, con diversa gravedad, de los otros vagabundos.

(fuente: himikatus.ru )
Como comentó Chris H, también hay una pregunta sobre cuándo se controlan otros elementos de aleación. Generalmente, la adición de la aleación se controla lo más cerca posible de la solidificación, para minimizar la pérdida de la aleación.
La chatarra se funde a granel en un horno de arco eléctrico. Si la corriente de chatarra está suficientemente mezclada, entonces la concentración de la trampa puede estimarse en función del uso pasado y el hierro primario se agrega antes del análisis químico para compensar la estimación. Luego se funde la masa, se elimina el oxígeno mediante la adición de elementos en la parte inferior del diagrama de Ellingham, específicamente Ca y Al, y el metal fundido se transfiere a una o más cucharas altamente aisladas. El Ca y el Al reaccionan rápidamente con el oxígeno disuelto en la masa fundida para crear escoria de óxido de baja densidad que flota y se elimina mecánicamente. La química se toma después de este proceso, y si los vagabundos están suficientemente diluidos, el metal se transfiere a cucharones. Si no, se agrega suficiente hierro primario para diluir la masa fundida.
Una vez en la cuchara, se agregan elementos de aleación adicionales. No se agregaron antes debido al diagrama de Ellingham: la mayoría de los elementos de aleación, incluidos Mn, Mo, Cr, V, C, etc. tienen una mayor pérdida de energía libre que el Fe, por lo que reaccionan primero. En otras palabras, se desvanecen. Para evitar el costoso desvanecimiento por adición de aleaciones, se agregan lo más cerca posible del proceso de solidificación. Además, al eliminar el oxígeno usando Al y Ca primero, hay menos oxígeno disuelto en el hierro para reaccionar con los elementos de aleación más caros. Una vez en la cuchara, hay muy poca turbulencia de la interfaz líquido-atmósfera, por lo que la difusión de oxígeno nuevo al hierro líquido es relativamente lenta. Por supuesto, todavía hay un límite de tiempo, y sostener un cucharón durante demasiado tiempo provocará la decoloración de la aleación. Después de la adición de la aleación, se verifica la química y luego se vierte la cuchara.
Editado para agregar fuentes. Editado para agregar una discusión sobre el control de aleaciones.

